Nat Commun:欧阳松应教授团队揭示Sir2-HerA系统在致病菌抗噬菌体免疫中的激活机制
来源:生物探索 2024-11-08 10:12
研究人员提出了Sir2-HerA系统复合物组装和别构激活模型,详细解释了Sir2-HerA系统在抵御噬菌体入侵过程中的分子机制。
近日,福建师范大学生命科学学院欧阳松应教授团队合作在Nature Communications在线发表了题为Mechanistic basis for the allosteric activation of NADase activity in the Sir2-HerA antiphage defense system 的论文。该研究通过生物信息学、结构生物学,并结合生物化学等实验技术,揭示了Sir2-HerA系统是如何在致病菌免疫中激活并发挥抗噬菌体功能的分子机制。

Sir2蛋白家族是一类广泛存在于细菌、古菌以及高等真核生物中的保守蛋白家族。在真核生物体内,Sir2蛋白利用NAD+作为辅助因子,发挥蛋白去乙酰化酶或ADP-核糖基转移酶功能。而在原核生物多个抗噬菌体防御系统,如欧阳松应团队此前发表的SPARSA系统(Nat Communi 10.1038/s41467-023-44660-7)和Sir2-HerA等都包含Sir2结构域蛋白。尽管最近鉴定了多种Sir2相关的抗噬菌体系统,但Sir2作为NAD+水解酶的活性如何被激活仍不清楚。
在本研究中,研究人员选取了Staphylococcus aureus 菌株中Sir2-HerA系统作为研究对象,首先通过Pull-Down实验发现Sir2和HerA之间存在相互作用,并在体外实验中发现单独Sir2不具有NAD+酶活性,但在与HerA形成复合物后,Sir2蛋白的NAD+水解酶活性被激活,表现出很强的水解NAD+能力。然而,在未受到噬菌体感染时,Sir2的酶活性会受到细胞内生理浓度ATP的抑制。
为了解释HerA如何激活Sir2的NAD+水解酶活性,研究人员进一步利用冷冻电镜技术(Cryo-EM)解析了Sir2-HerA的复合物结合ADPR的结构(分辨率为2.81Å)。该复合物是由12个 Sir2分子与6个 HerA分子组成超大复合物。通过分析复合物结构,研究人员发现Sir2蛋白排列成两层六元环结构,但是仅在与HerA蛋白直接接触的Sir2六元环中观察到了NAD+的水解产物ADPR的密度,ADPR位于Sir2蛋白的小结构域和Rossmann结构域之间,这是Sir2蛋白与NAD+结合的典型位点,而在另一层六元环的Sir2分子中并未发现ADPR的存在。
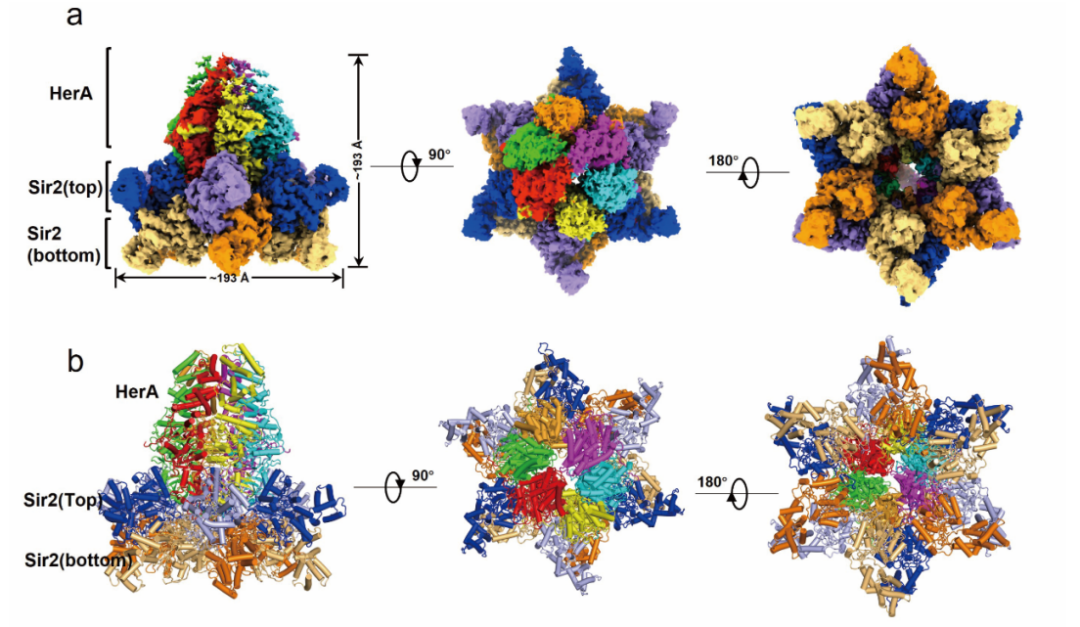
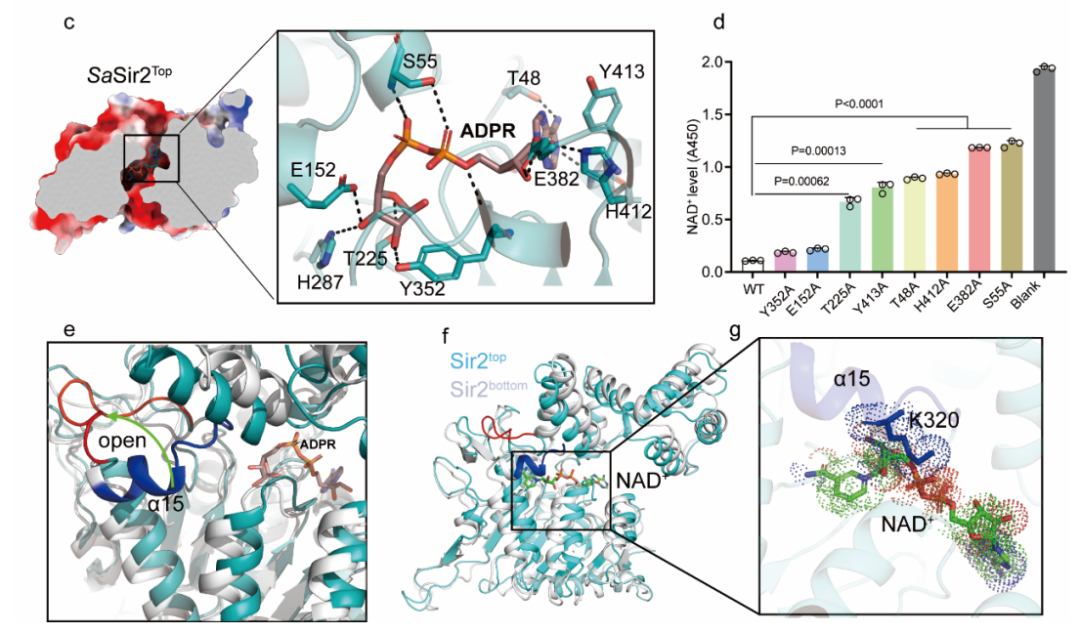
图1 Sir2-HerA的冷冻电镜结构及HerA的结合激活Sir2的结构基础(Credit: Nature Communications)
为了探究Sir2酶活的激活机制,研究人员将结合ADPR的Sir2结构与下层未结合ADPR的Sir2结构,以及通过AlphaFold预测的Sir2模型进行详细比对,结果发现与HerA直接接触的Sir2酶活位点的上方的α15螺旋变为了一个loop,并向远离ADPR的方向弯曲,这种结构变化增大了Sir2 NAD+酶活口袋。研究人员推测,这种构象变化可能使NAD+可以接近Sir2的酶活中心,从而被水解。
为了验证上述猜想,研究人员利用BLI技术发现,单独的Sir2并不结合NAD+,而Sir2-HerA的突变体具有结合NAD+的能力。此外,通过删除Sir2单体的α15螺旋并进行体外NAD+酶活实验,发现截短后的Sir2蛋白单体不需要HerA的结合即可表现出NAD+酶活性,这些结果表明,α15螺旋在激活Sir2-HerA系统的激活过程中发挥了重要作用。
综上所述,研究人员提出了Sir2-HerA系统复合物组装和别构激活模型,详细解释了Sir2-HerA系统在抵御噬菌体入侵过程中的分子机制。这些发现不仅加深了对原核生物Sir2-HerA防御系统的理解,也为进一步研究微生物抗噬菌体的免疫系统提供了理论基础。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


